บทนำ
Matrix-Assisted Laser Desorption/Ionization Time-of-Flight Mass Spectrometer (MALDI-TOF MS) เป็นเครื่องมือที่ใช้ในการวิเคราะห์หาน้ำหนักโมเลกุลของสาร ซึ่งเทคนิค MALDI เป็นกระบวนการทำให้สารเกิดเป็นไอออน (Ionization) ก่อนวิเคราะห์ด้วยเทคนิค Mass spectrometry ที่ถูกพัฒนาขึ้นพร้อม ๆ กับเทคนิค Electrospray ionization (ESI) ในปี ค.ศ. 1988 เริ่มแรกมีวัตถุประสงค์เพื่อใช้ในการวิเคราะห์น้ำหนักโมเลกุลของสารชีวโมเลกุลขนาดใหญ่ โดยเฉพาะโปรตีนและเพปไทด์ เนื่องจากโมเลกุลของสารเหล่านี้ไม่ระเหย โมเลกุลเสียสภาพได้ง่ายที่อุณหภูมิสูง และทำให้เกิดเป็นไอออนได้ยาก (Griffiths, J.; 2008) และในปี ค.ศ. 1992 ได้มีการนำมาใช้ในการวิเคราะห์พอลิเมอร์สังเคราะห์ที่มีน้ำหนักโมเลกุลสูงกว่า 100,000 ดาลตัน ได้อย่างมีประสิทธิภาพ (Li, L.; 2009) ในปัจจุบัน MALDI-TOF MS เป็นเทคนิคที่นิยมอย่างแพร่หลายเพื่อประยุกต์ใช้ในการวิเคราะห์น้ำหนักโมเลกุลของสารโมเลกุลขนาดใหญ่ (Macromolecules) ชนิดอื่น ๆ เช่น Polysaccharides, Lipids, Glycoproteins รวมถึงสารโมเลกุลขนาดเล็ก (Small molecules) และสารประกอบโลหะเชิงซ้อนบางชนิด ได้อย่างมีประสิทธิภาพและรวดเร็ว
หลักการทำงาน
เทคนิค MALDI-TOF MS ประกอบด้วย 2 กระบวนการหลัก ๆ (รูปที่ 1) ได้แก่ การทำให้สารแตกตัวเป็นไอออนด้วยเทคนิค MALDI และการตรวจวัดไอออนที่เกิดขึ้นด้วยเครื่องวิเคราะห์มวลแบบ Time-of-Flight (TOF) mass spectrometer โดยทั่วไปวิธีเตรียมตัวอย่าง เริ่มจากผสมสารละลายสารตัวอย่างกับสารละลาpเมทริกซ์ (Matrix) ในอัตราส่วนที่เหมาะสม แล้วหยด (Spot) สารผสมลงบนแผ่นโลหะสำหรับหยดตัวอย่าง (MALDI target plate) จากนั้นระเหยตัวทำละลายในสารผสมจนแห้งเกิดเป็นผลึกระหว่างสารตัวอย่างกับเมทริกซ์ (Co-crystallization) ก่อนนำเข้าเครื่อง MALDI-TOF MS
เมื่อนำ Target plate เข้าเครื่องวัดมวลที่ทำให้อยู่ในสภาวะสุญญากาศ จะทำการฉายเลเซอร์ชนิดที่ปล่อยลำแสงออกมาเป็นจังหวะ โดยทั่วไปมักเป็นเลเซอร์ในช่วงความยาวคลื่นอัลตราไวโอเลต (Pulsed UV laser) ลงบน Sample spot ของผลึกสารผสม เมทริกซ์ซึ่งมีปริมาณมากกว่าและดูดกลืน (Absorb) แสงเลเซอร์ได้ดีกว่าสารที่สนใจ จะถูกกระตุ้นด้วยพลังงานความร้อนจากแสงเลเซอร์ ทำให้ชั้นโมเลกุลเมทริกซ์ถูกไอออไนซ์ในสภาวะแก๊สได้ก่อนสารตัวอย่าง ในขณะเดียวกันเมทริกซ์ไอออนจะทำหน้าที่เป็นตัวกลางถ่ายเทประจุหรือโปรตอน และพลังงานไปยังโมเลกุลของสารตัวอย่าง ทำให้สารที่สนใจแตกตัวเป็นไอออนในสภาวะแก๊สได้ ปรากฏการณ์นี้เรียกว่า Desorption/Ionization ดังรูปที่ 2 ซึ่งเกิดขึ้นที่ชั้นผลึกในระดับไมโครเมตรในช่วงเวลานาโนวินาที (Hillenkamp, F. et al.; 2007 และแม้น อมรสิทธิ์ และคณะ 2555) จากนั้นไอออนเหล่านี้จะเคลื่อนที่ไปในท่อสุญญากาศ และถูกตรวจวัดด้วยเครื่องวัดมวลแบบ Time-of-Flight (TOF) โดยความเร็วในการเคลื่อนที่ของไอออนขึ้นอยู่กับขนาดของมวลต่อประจุ (m/z) กล่าวคือไอออนของสารใดที่มีมวลน้อยจะสามารถเคลื่อนที่ในท่อสุญญากาศ (TOF tube) ได้เร็วกว่าสารที่มีมวลมาก จึงเดินทางไปยังตัวตรวจรับ (Detector) ได้ก่อน ทำให้สามารถตรวจวัดระยะเวลาที่ไอออนเคลื่อนที่ (Time of flight) และคำนวณขนาดมวลสารได้ รวมถึงแสดงผลออกมาในรูปสเปกตรัมมวลต่อประจุของสาร (Mass spectrum)
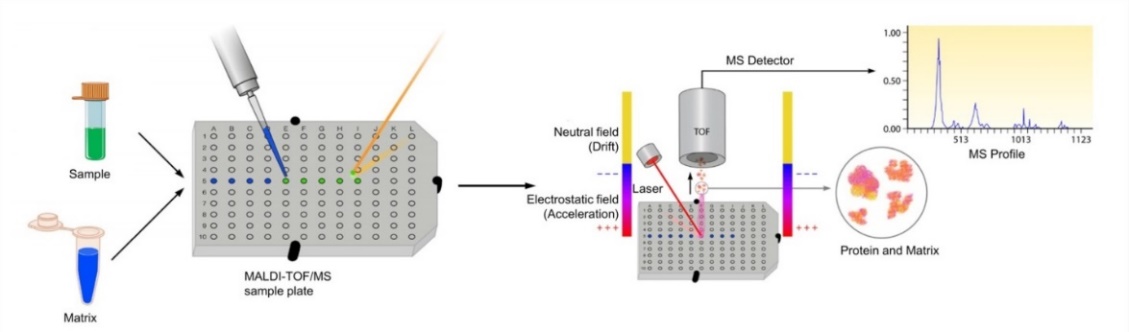
รูปที่ 1 The process of MALDI-TOF mass spectrometry (Clark, A. E., et al.; 2013)
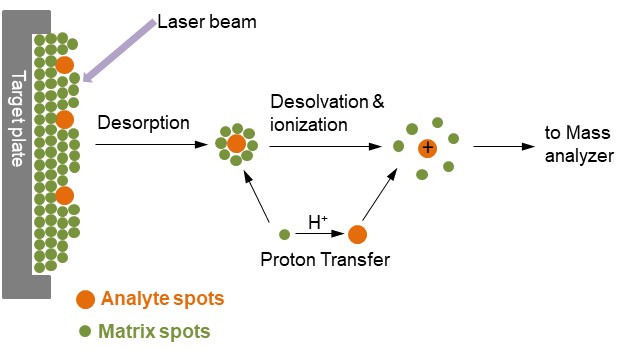
รูปที่ 2 การเกิดเป็นไอออนของสารด้วยเทคนิค MALDI (https://www.creative-proteomics.com/technology/maldi-tof-mass-spectrometry.htm)
กลไกการแตกตัวเป็นไอออนของสารด้วยเทคนิค MALDI
เทคนิค MALDI เป็นกระบวนการที่ทำให้สารแตกตัวเป็นไอออนแบบ Soft ionization วิธีหนึ่งเช่นเดียวกับเทคนิค Electrospray ionization (ESI) แต่สถานะของสาร (Analyte state) เริ่มต้นก่อนทำให้สารเกิดเป็นไอออนแตกต่างกัน ซึ่ง MALDI ทำให้สารแตกตัวเป็นไอออนโดยฉายเลเซอร์ (Laser ablation) ลงบนตัวอย่างที่เป็นของแข็ง (Solid phase) ในขณะที่ ESI เป็นการฉีดตัวอย่างที่เป็นรูปสารละลายของเหลว (Solution) เกิดเป็นละอองฝอยขนาดเล็ก (Spray) ผ่านหัวฉีดที่มีสนามไฟฟ้าแรงสูง
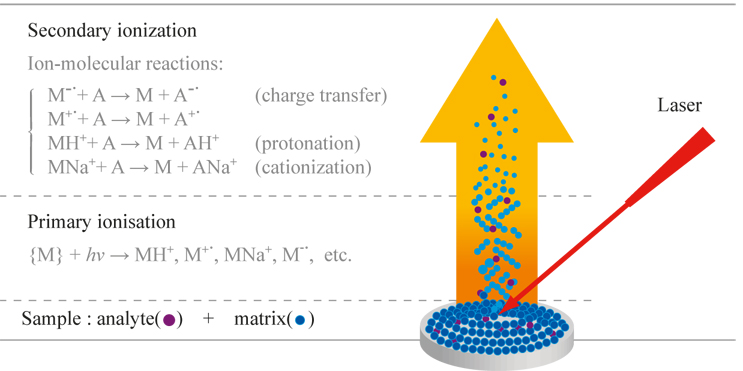
รูปที่ 3 กลไกการเกิด ionization ด้วยเทคนิค MALDI (http://eng.thesaurus.rusnano.com/wiki/article1121)
เมทริกซ์ (Matrix) เป็นหัวใจสำคัญที่ทำให้โมเลกุลขนาดใหญ่ถูกไอออไนซ์ได้ดี ทำหน้าที่เป็นตัวช่วยในการดูดกลืนพลังงานความร้อนจากแสงเลเซอร์ก่อน แล้วถ่ายเทประจุและพลังงานไปยังโมเลกุลของสาร เกิดเป็นไอออนของโมเลกุลสารตัวอย่างในสภาวะแก๊สเรียกว่า Molecular ion (M+.) โดยไม่เกิดการแตกหักของโมเลกุลหรือเกิดการแตกหักเป็นไอออนย่อย (fragmentation ions) ได้น้อยมาก มักตรวจพบไอออนของสารในรูปของโมเลกุลสารเริ่มต้น (M) ที่ถูกเติมหรือกำจัดประจุออก หรือเรียกว่า quasi-molecular ions เช่น ไอออนของโมเลกุลที่มีการเติมโปรตอน [M+H]+ ไอออนของโมเลกุลที่มีการเติมโซเดียมไอออน [M+Na]+ หรือไอออนของโมเลกุลที่มีการกำจัดโปรตอน [M-H]– เป็นต้น โดย quasi-molecular ions สามารถพบในรูป [M+nH]n+ ซึ่งมักพบไอออนที่มีประจุเดียว (singly charged ions) มากกว่าหลายประจุ (multiply charged ions) ทั้งนี้ขึ้นกับชนิดของเมทริกซ์และความเข้มของเลเซอร์ที่เลือกใช้ โดยกระบวนการแตกตัวเป็นไอออนของสารและไอออนที่เกิดขึ้นจากเทคนิค MALDI (Hillenkamp, F. et al.; 2007) แสดงดังรูปที่ 3
ส่วนประกอบของเครื่อง MALDI-TOF MS
เครื่อง MALDI-TOF MS ประกอบด้วย 3 ส่วนหลัก ได้แก่
1) แหล่งกำเนิดไอออน (Ion source) แบบ MALDI เป็นบริเวณทำให้สารแตกตัวเป็นไอออน เริ่มจากการฉาย pulsed UV laser ลงบนผิวของตัวอย่างบน target plate ซึ่งอยู่ในระบบสุญญากาศสูงและควบคุม electrostatic field ทำให้สารแตกตัวเป็นไอออนในสภาวะแก๊ส แล้วเคลื่อนที่ไปเกิดการแยกในส่วนวิเคราะห์ไอออนต่อไป
2) ส่วนวิเคราะห์มวล (Mass analyzer) แบบ TOF analyzer โดยทั่วไปมี 2 แบบ ได้แก่ Linear TOF analyzer และ Reflectron TOF analyzer ดังรูปที่ 4 ในที่นี้ขออธิบายหลักการเบื้องต้นของ Linear TOF analyzer คือ เมื่อไอออนเคลื่อนที่สู่ TOF tube ในภาวะสุญญากาศ ในช่วงต้นไอออนจะถูกเร่งโดยพัลส์ของสนามไฟฟ้าด้วยความต่างศักย์ประมาณ 20 kV จนมีความเร็วค่าหนึ่ง (v) ซึ่งขึ้นอยู่กับขนาดของมวลต่อประจุ (m/z) ของไอออน และปล่อยให้ไอออนเคลื่อนที่หรือบิน (Fly) อย่างอิสระผ่านบริเวณที่ปราศจากอิทธิพลของสนามไฟฟ้า (Electric-field-free region) หรือ Drift zone (Flight path) เป็นระยะทาง d ในเวลาหนึ่ง (t) โดยระยะเวลาในการบินจะสั้นในระดับไมโครวินาที ก่อนถึงเครื่องตรวจวัด กล่าวคือไอออนที่มีมวลน้อยจะเคลื่อนที่ไปถึงเครื่องตรวจวัดได้ก่อนไอออนที่มีมวลมากกว่านั่นเอง ปกติ TOF tube มีความยาวของส่วน Flight path ประมาณ 1-2 เมตร ทำให้มีประสิทธิภาพสูงในการแยกมวลไอออน (High resolution) และมีความไวสูงในการตรวจวัดไอออน (High sensitivity) โดยจัด TOF อยู่ในกลุ่มเครื่องวิเคราะห์มวลแบบความละเอียดสูง (High resolution MS) ที่สามารถแยกมวลไอออนที่อยู่ติดกันได้และอ่านค่า m/z ของไอออนได้ละเอียดถึงทศนิยม 4 ตำแหน่ง
3) ส่วนตรวจวัด (Detector) เป็นส่วนตรวจวัดไอออนที่แยกได้จากส่วน Mass analyzer โดยส่วนใหญ่เป็นประเภทเพิ่มความเข้มหรือขยายสัญญาณแบบ Electron multiplier
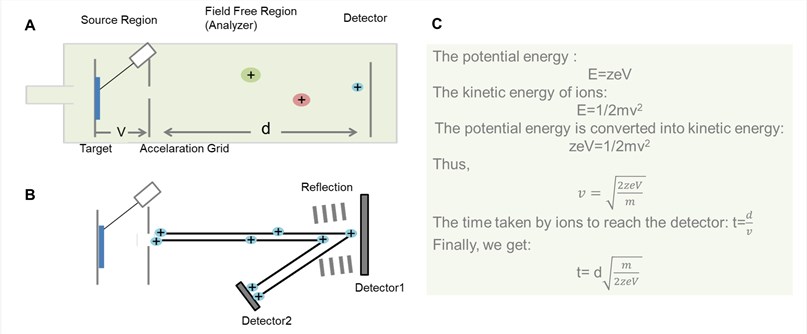
รูปที่ 4 General schematic for TOF analyzer. (A) Linear TOF analyzer; (B) Reflectron TOF analyzer; (C) The derivation process of the time that ions pass through field free region in the linear TOF analyzer. (https://www.creative-proteomics.com/technology/maldi-tof-mass-spectrometry.htm)
เมทริกซ์ (Matrix)
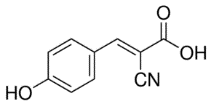
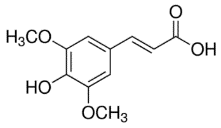
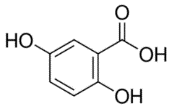
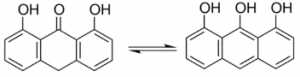
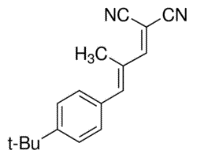
เมทริกซ์ คือ สารอินทรีย์โมเลกุลขนาดเล็ก (มวลโมเลกุลอยู่ในช่วง 100-300 g/mol) ทำหน้าที่เป็นตัวกลางช่วยรับพลังงานจากเลเซอร์ แล้วถ่ายเทประจุและพลังงานไปยังโมเลกุลของสารที่ต้องการวิเคราะห์ ทำให้สารโมเลกุลขนาดใหญ่เกิดเป็นไอออนได้ โดยเมทริกซ์สำหรับเครื่อง MALDI-TOF MS ที่มีเลเซอร์แบบ UV laser มักเป็นสารประกอบอะโรมาติก (Aromatic compounds) ที่มีหมู่คาร์บอกซิล (-COOH) และ/หรือหมู่ไฮดรอกซิล (-OH) เป็นองค์ประกอบ เนื่องจากมีสมบัติสามารถดูดกลืนพลังงานจากเลเซอร์ช่วงคลื่นอัลตราไวโอเลตได้ดี เมทริกซ์ที่นิยมใช้โดยทั่วไป เช่น α-cyano-4-hydroxycinnamic acid (CHCA), 3,5-dimethoxy-4-hydroxycinnamic acid (SA),2,5-dihydroxybenzoic acid (DHB), 1,8,9-Anthracenetriol (Dithranol), trans-2-[3-(4-tert-Butylphenyl)-2-methyl-2-propenylidene]malononitrile (DCTB) และ 2-(4-hydroxyphenylazo)benzoic acid (HABA) เป็นต้น
เมทริกซ์เป็นหัวใจสำคัญของเทคนิค MALDI-TOF MS โดยเมทริกซ์แต่ละชนิดมีความสามารถในการทำให้สารแต่ละชนิดเกิดเป็นไอออนบวกหรือลบได้แตกต่างกันในช่วงน้ำหนักโมเลกุลที่ต่างกันอีกด้วย เช่น CHCA และ SA มักใช้ในงานวิเคราะห์โปรตีนหรือเพปไทด์ที่มีขนาดโมเลกุลน้อยกว่า 10 กิโลดาลตัน และขนาดมากกว่า 10 กิโลดาลตัน ในโหมดไอออนบวก ตามลำดับ ส่วน DHB และ Dithranol มักใช้ในงานวิเคราะพอลิเมอร์และสารสังเคราะห์ เป็นต้น ดังนั้นการเลือกใช้เมทริกซ์ที่เหมาะสมกับตัวอย่างชนิดนั้น ๆ จึงเป็นสิ่งที่ต้องพิจารณาเป็นอย่างแรกในขั้นตอนการเตรียมตัวอย่างก่อนการวิเคราะห์ด้วยเครื่อง MALDI-TOF MS ตัวอย่างของเมทริกซ์ที่เหมาะสมกับสารตัวอย่างประเภทต่าง ๆ แสดงในตารางที่ 1
การเตรียมตัวอย่าง
การเตรียมตัวอย่างก่อนการวิเคราะห์ด้วยเครื่อง MALDI-TOF MS เป็นขั้นตอนที่มีความสำคัญมาก เป้าหมายคือทำให้สารตัวอย่างถูกไอออไนซ์ได้อย่างสมบูรณ์ และไม่แตกสลายด้วยเลเซอร์ สามารถตรวจวัดและประมวลผลได้สเปกตรัมมวลต่อประจุของสารที่ชัดเจน เที่ยงตรง และถูกต้องแม่นยำ โดยการเตรียมตัวอย่างที่ดีจะต้องทำให้เกิดเป็นผลึกของแข็งระหว่างสารตัวอย่างกับเมทริกซ์ที่กระจายตัวอย่างสม่ำเสมอบน Target plate ซึ่งสิ่งที่จำเป็นต้องพิจารณา ได้แก่
1) ชนิดของเมทริกซ์
2) ชนิดของตัวทำละลายตัวอย่างและเมทริกซ์
3) วิธีการเตรียมตัวอย่างลงบน Target plate
ซึ่งวิธีการเตรียมตัวอย่างลงบน MALDI target plate (Sample and matrix deposition) แบ่งออกเป็น 2 กรณีหลัก ๆ ได้แก่
1) กรณีที่ตัวอย่างเป็นของเหลว หรือเป็นของแข็งที่สามารถละลายในตัวทำละลายให้อยู่ในรูปของเหลวได้ มักจะนำไปผสมกับสารละลายเมทริกซ์ที่เหมาะสมทั้งชนิดและปริมาณ แล้วหยด (Spot) สารผสมลงบน MALDI target plate จากนั้นรอให้สารผสมแห้งจนเกิดเป็นผลึกก่อนนำเข้าเครื่อง วิธีนี้เป็นวิธีเตรียมตัวอย่างที่นิยมใช้กันทั่วไป บางครั้งอาจเรียกวิธีนี้ว่า Dried-droplet method
2) กรณีที่ตัวอย่างเป็นของแข็งที่ไม่สามารถหาตัวทำละลายได้ หรือต้องการวิเคราะห์ชิ้นส่วนตัวอย่างในรูปของแข็ง ให้ตัดชิ้นส่วนตัวอย่างลงบน MALDI target plate แล้วสเปรย์สารละลายเมทริกซ์ลงบนผิวตัวอย่างให้สม่ำเสมอ รอให้แห้ง แล้วจึงนำไปวิเคราะห์
เมทริกซ์ | ชื่ออื่นๆ | การประยุกต์ใช้ |
α-cyano-4-hydroxycinnamic acid mw. 189.17 g/mol
| CHCA CCA HCCA | Mid-weight molecules <5 kDa Peptides, proteins mass <10 kDa Carbohydrates Mostly used in positive ion mode |
3,5-dimethoxy-4-hydroxycinnamic acid mw. 224.21 g/mol
| Sinapic acid Sinapinic acid SA | High-weight molecules >5 kDa Peptides, proteins mass >10 kDa Dendrimers, fullerrenes Mostly used in positive ion mode |
2,5-dihydroxybenzoic acid mw. 154.12 g/mol
| DHB | Lower-weight molecules, small molecules <2 kDa Polymers, peptides, nucleotides, oligonucleotides, and oligosaccharides, that do not ionize well with CHCA or SA Organic molecules, carbohydrates More appropriate for positive ion mode analysis |
Dithranol mw. 226.23 g/mol
| Anthralin INN DTN | Synthetic polymers (non-polar) Small molecules (mw. <2 kDa) Lipids Dendrimers |
trans-2-[3-(4-tert-Butylphenyl)-2-methyl-2-propenylidene]malononitrile mw. 250.34 g/mol
| DCTB | Inorganic molecules Metal complexes Fullerrenes, dendrimers Synthetic polymers Polythiophenes Softer matrix than DHB and dithranol |
ตารางที่ 1 แสดงตัวอย่างเมทริกซ์ที่นิยมใช้สำหรับงานวิเคราะห์น้ำหนักโมเลกุลของสารประเภทต่าง ๆ (Leopold, J. et al.; 2018 และ Nielen, M. W.F.; 1999)
นอกจากนี้ตัวอย่างประเภทต่าง ๆ ที่นำมาวิเคราะห์ด้วยเทคนิค MALDI-TOF MS จำเป็นต้องมีความบริสุทธิ์ ไม่มีสารเจือปนที่รบกวนการวิเคราะห์ มีปริมาณและความเข้มข้นที่เหมาะสม โดยข้อมูลการเตรียมตัวอย่างแต่ละประเภทยังไม่มีวิธีการเตรียมตัวอย่างที่เป็นมาตรฐาน (Standard protocols) มีเพียงข้อแนะนำเบื้องต้น (Guidelines) ดังนั้นผู้วิเคราะห์ต้องทดลองและปรับเปลี่ยน (trial and error) ในขั้นตอนการเตรียมตัวอย่างจากหลักการเบื้องต้นหรืองานวิจัยที่เกี่ยวข้องเพื่อให้เหมาะสมกับตัวอย่างนั้น ๆ เช่น
– พอลิเมอร์สังเคราะห์ มักใช้ Tetrahydrofuran (THF) เป็นตัวทำละลาย ส่วนเมทริกซ์ที่ใช้มีหลายชนิด เช่น DHB, Dithranol, CHCA เป็นต้น และใช้การเตรียมตัวอย่างแบบ Dried-droplet method (Nielen, M. W.F.; 1999)
– โปรตีนหรือเพปไทด์ที่มีขนาดมากกว่า 10 KDa มักใช้ CHCA เป็นเมทริกซ์ละลายใน 50% acetonitrile/water+0.1% TFA เตรียมตัวอย่างแบบ Dried-droplet method เป็นต้น
ผลวิเคราะห์ที่ได้จากเครื่อง MALDI-TOF MS
MALDI-TOF MS เป็นเครื่องมือสำหรับวิเคราะห์มวลสารประเภทหนึ่ง โดยผลที่ได้จากเครื่อง คือ สเปกตรัมมวลหรือแมสสเปกตรัม (Mass spectrum) เป็นกราฟที่แสดงค่ามวลต่อประจุ (m/z) ของไอออนที่ตรวจวัดได้ กับค่าการตอบสนอง (Response) ต่อเครื่องตรวจวัดที่แสดงออกมาในรูปของร้อยละความอุดมสมบูรณ์สัมพัทธ์ (%Relative abundance) หรืออาจแสดงเป็นความเข้มของสัญญาณ (Intensity) ที่ตรวจวัดได้ต่อหน่วยเวลา (counts per second, cps) รูปที่ 5
สำหรับ Mass spectrum ที่ได้จากเครื่อง MALDI-TOF MS เป็นผลเชิงคุณภาพเพื่อระบุมวลของไอออนที่ตรวจพบ เนื่องจากเป็นกระบวนการ Soft ionization ค่า m/z ที่ตรวจพบมักอยู่ในรูป Molecular ion ดังที่กล่าวมาแล้ว เช่น M+., [M+H]+, [M+Na]+, [M-H]–, หรือ [M+nH]n+ เป็นต้น เนื่องจากประจุ (z) ที่เกิดขึ้นมีค่าเป็น +1 หรือ -1 ดังนั้น ค่า m/z ของไอออนที่ตรวจวัดได้จะมีค่าเท่ากับน้ำหนักโมเลกุลของสารที่สนใจ ซึ่งข้อมูลน้ำหนักโมเลกุลที่ได้ สามารถนำไประบุขนาดและโครงสร้างของโมเลกุลได้ อย่างไรก็ดีจำเป็นต้องใช้เทคนิคอื่น ๆ วิเคราะห์ควบคู่ด้วย เพื่อการแปรผลข้อมูลที่ถูกต้อง เช่น
– การวิเคราะห์น้ำหนักโมเลกุลของพอลิเมอร์ ควรใช้เทคนิค Gel permeation chromatography (GPC) เพื่อหาช่วงน้ำหนักโมเลกุลเฉลี่ย (Mw และ Mn) และการกระจายตัวของน้ำหนัก (PDI) หากมีค่า PDI > 1.2 จะทำให้การทดสอบด้วยเครื่อง MALDI-TOF MS มีความคลาดเคลื่อน (Kona B., et al, 2006)
– การวิเคราะห์น้ำหนักโมเลกุลของโปรตีน เพปไทด์ ควรใช้เทคนิค Sodium Dodecyl Sulfate polyacrylamide gel electrophoresis (SDS-PAGE) ในการหาช่วงน้ำหนักโมเลกุลควบคู่ไปด้วย และใช้เทคนิค Liquid chromatography-Electrospray ionization-Mass spectrometry (LC-ESI-MS) ในการยืนยันโครงสร้างหรือลำดับโปรตีนของสายเพปไทด์
– การวิเคราะห์น้ำหนักโมเลกุลเพื่อพิสูจน์โครงสร้างของพอลิเมอร์สังเคราะห์ สารประกอบเชิงซ้อนของโลหะ และสารโมเลกุลขนาดเล็ก ควรใช้เทคนิค Nuclear magnetic resonance spectroscopy (NMR) ร่วมด้วย และตัวอย่างที่ทดสอบควรมีความบริสุทธิ์สูง
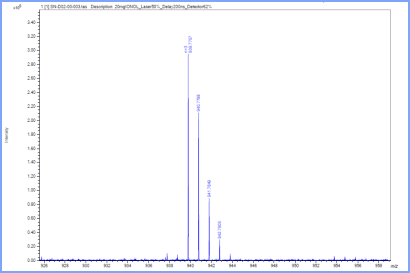
รูปที่ 5 แสดง Mass spectrum ของสาร แกน x เป็นค่ามวลต่อประจุ (m/z) แกน y เป็นความเข้มของสัญญาณ (cps)
นอกจากนี้ Mass spectrum ที่ได้จากเครื่อง MALDI-TOF MS ไม่นิยมใช้เป็นข้อมูลเชิงปริมาณ เป็นการวัดมวลของสารที่เกิดเป็นไอออนได้ทั้งหมดในตัวอย่าง ความเข้มของสัญญาณ (Intensity) ของค่า m/z ที่พบไม่ได้บ่งบอกถึงปริมาณสารในตัวอย่าง กล่าวคือค่า m/z ที่มี intensity สูง ไม่ได้แสดงว่ามีไอออนหรือโมเลกุลของสารนี้มากในตัวอย่าง แต่บอกว่าที่ตำแหน่งหรือบริเวณที่ฉายเซเลอร์ลงไปสารถูกไอออไนซ์ได้ดี จึงให้ความเข้มสูง อีกทั้งการฉายเลเซอร์เป็นการสุ่มยิงไปที่ตำแหน่งต่าง ๆ บน sample spot ที่มีการกระจายตัวของผลึกตัวอย่างและเมทริกซ์ หากสารนั้นมีการกระจายตัวอย่างสม่ำเสมอทั่วทั้ง sample spot โอกาสที่สารจะถูกไอออไนซ์ด้วยเลเซอร์ก็มีมากเช่นกัน
เครื่องมือที่ให้บริการวิเคราะห์ทดสอบ
ปัจจุบันเครื่อง MALDI-TOF MS มีหลากหลายรุ่นและหลายยี่ห้อ บริษัทผู้ผลิตหลัก ได้แก่ Shimadzu, Bruker, JEOL, Waters และ SCIEX โดยแต่ละยี่ห้อมีเทคโนโลยีที่เป็นจุดเด่นแตกต่างกันและมีราคาตั้งแต่ 10-70 ล้านบาท ส่วนใหญ่จะพิจารณาจากประสิทธิภาพในการแยก (Resolution หรือ Mass resolving power, m/∆m) ตั้งแต่ ต่ำกว่า 2,000, 2,000-5,000 และสูงกว่า 5,000 ซึ่งขึ้นอยู่กับส่วนวิเคราะห์มวล (TOF technology) หรืองานที่ประยุกต์ใช้ (Applications) นอกจากนี้ยังมีโปรแกรมหรือซอฟแวร์ที่ใช้ช่วยประมวลผล หรือมีส่วนฮาร์ดแวร์เพิ่มเติมที่ใช้กับตัวอย่างที่หลากหลายมากขึ้น เช่น Imaging analysis สำหรับงานทางด้านชีวโมเลกุลทางการแพทย์ (Biopharmaceuticals) หรืองานศึกษาวิจัยทางพยาธิวิทยา และงานวิจัยทางด้านโลหะและวัสดุ เป็นต้น
เครื่อง MALDI-TOF MS ของศูนย์เครื่องมือวิจัยวิทยาศาสตร์และเทคโนโลยี จุฬาลงกรณ์มหาวิทยาลัย ที่ให้บริการวิเคราะห์ทดสอบเป็นของบริษัท JEOL (JEOL SpiralTOFTM MALDI TOF/TOF Mass Spectrometer) รุ่น JMS-S3000 ในส่วน MALDI source ใช้เลเซอร์เป็น 349 nm Nd:YLF (Neodymium-Doped Yttrium Lithium Fluoride) solid-state UV laser และมีจุดเด่นคือในส่วนของ TOF analyzer ใช้เทคโนโลยี SpiralTOFTM แบบ multi-turn ion optical system ที่ใช้ TOF tube มีลักษณะเป็นท่อยาวขดต่อเนื่องกัน (Spiral) รูปที่ 6 มี Flight distance ยาวถึง 17 เมตร ทำให้มีค่าประสิทธิภาพการแยก หรือ Mass resolving power มากกว่า 75,000 จึงสามารถนำมาประยุกต์ใช้ในการวิเคราะห์น้ำหนักโมเลกุลของสารขนาดเล็ก (Small molecules) ได้ และยังมีส่วน Linear TOF option ที่เป็นแบบ Linear mode system (MS1) และ Parabolic reflectron system (MS2) ที่มี Flight distance ยาวถึง 1.2 เมตร และ 1.5 เมตร ตามลำดับ โดยมี Mass resolving power มากกว่า 2,000 ซึ่งเครื่องสามารถวิเคราะห์มวลแบบ MS/MS ในการแตกไอออนย่อยของไอออนที่สนใจ (Precursor ions) เพื่อใช้ในการยืนยันโครงสร้างโมเลกุลของสารได้ อีกทั้ง JEOL SpiralTOF MS สามารถทำการวิเคราะห์ตัวอย่างแบบ MALDI-imaging-MS ซึ่งเป็นการถ่ายภาพพร้อมกับการวิเคราะห์มวลสารที่สนใจบนตำแหน่งต่าง ๆ ของชิ้นส่วนตัวอย่างจริงที่ตัดลงบนแผ่นสไลด์แก้ว แล้วสเปรย์เมทริกซ์ลงไปตัวตัวอย่าง เช่น ชิ้นเนื้อ เนื้อเยื่อต่าง ๆ ของสัตว์ทดลอง ชิ้นส่วนของพืช ใบไม้ ดอกไม้ เป็นต้น ทำให้ทราบข้อมูลทางพยาธิของตัวอย่าง และการกระจายตัวของสารที่สนใจบนตำแหน่งต่าง ๆ ของตัวอย่างได้

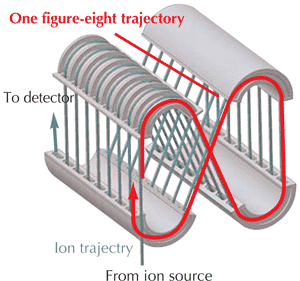
รูปที่ 6 แสดงลักษณะของเครื่อง JEOL SpiralTOFTM MALDI TOF/TOF Mass Spectrometer (ซ้าย) และ Spiral TOF system (ขวา) (https://www.jeol.co.jp/en/products/detail/JMS-S3000.html)
โดยสรุปเครื่อง MALDI-TOF MS ของศูนย์เครื่องมือฯ ที่ให้บริการวิเคราะห์ทดสอบสามารถวิเคราะห์ได้ 3 mode ดังนี้
1) การวิเคราะห์น้ำหนักโมเลกุลในช่วงต่าง ๆ
– Spiral mode: ช่วง m/z 4 – 30,000
– Linear mode: ช่วง m/z 4 – 500,000
2) การวิเคราะห์น้ำหนักโมเลกุลแบบแตกเป็นไอออนย่อย (MS/MS mode) โดย Precursor ions มีขนาด m/z 100 – 4,000
3) การวิเคราะห์แบบ Imaging MS mode
ข้อมูลเบื้องต้นเกี่ยวกับตัวอย่างที่ต้องการทดสอบ
ก่อนวิเคราะห์ทดสอบตัวอย่าง ควรทราบข้อมูลของตัวอย่าง เพื่อให้เกิดการแยกไอออนที่มีประสิทธิภาพ และแปรผลแมสสเปกตรัมที่ได้อย่างถูกต้อง ดังต่อไปนี้
1) ชนิดและประเภทของตัวอย่าง เช่น สารชีวโมเลกุล โปรตีน เพปไทด์ คาร์โบไฮเดรต พอลิเมอร์สังเคราะห์ เป็นต้น
2) ข้อมูลทางเคมี เช่น ขนาดหรือช่วงน้ำหนักโมเลกุลของสาร ชนิดของตัวทำละลาย
3) ปริมาณหรือความเข้มข้นของตัวอย่าง หากเป็นของแข็งจะใช้ปริมาณ 1-10 mg หากเป็นสารละลายควรมีความเข้มข้น 1-10 mg/mL
4) ชนิดของเมทริกซ์พร้อมตัวทำละลายเมทริกซ์ และ/หรือ สารช่วยให้เกิดการแตกตัวเป็นไอออนได้ดีขึ้น (Ionizing agent) มักเตรียมความเข้มข้นของสารละลายเมทริกซ์เริ่มต้น 10-20 mg/mL
5) Ion polarity ที่ใช้ในการวิเคราะห์ เป็น Positive หรือ Negative mode
รายการ | อัตราค่าวิเคราะห์/ตัวอย่าง (บาท) | |||
จุฬาฯ | มหาวิทยาลัยอื่น | ราชการ | เอกชน | |
1) Mass analysis per sample | 1,400 | 1,600 | 1,800 | 2,000 |
2) Mass analysis per hour (only certified user) | 1,050 | 1,200 | 1,350 | 1,500 |
3) MALDI-Imaging per hour (only experienced user) | 1,050 | 1,200 | 1,350 | 1,500 |
4) Image printing per image | 55 | 60 | 65 | 75 |
ติดต่อสอบถาม: ศูนย์เครื่องมือวิจัยวิทยาศาสตร์และเทคโนโลยี จุฬาลงกรณ์มหาวิทยาลัย
อาคารสถาบัน 2 ชั้น 1 ซอยจุฬา 62 ถนนพญาไท แขวงวังใหม่ เขตปทุมวัน กรุงเทพ 10330 โทร. 02-218-8233, 02-218-8101, 02-218-8107
ตัวอย่างการวิเคราะห์ (1)
Sample and matrix information | |
Sample | Bovine serum albumin (BSA) |
Sample concentration | 1 mg/mL in DDI water |
Matrix | 3,5-dimethoxy-4-hydroxycinnamic acid (SA) |
Matrix concentration | 10 mg/mL in 50% Acetonitrile/water and 0.1% Trifluoroacetic acid (TFA) |
Sample deposit method | Dried-droplet |
Sample : Matrix ratio | 1:1 |
MALDI-TOF MS parameter | |
Mode | Linear mode |
Ion polarity mode | Positive |
Mass range m/z | 20,000-100,000 |
Laser intensity | 65% |
Laser frequency | 20 Hz |
Delay time | 1,500 ns |
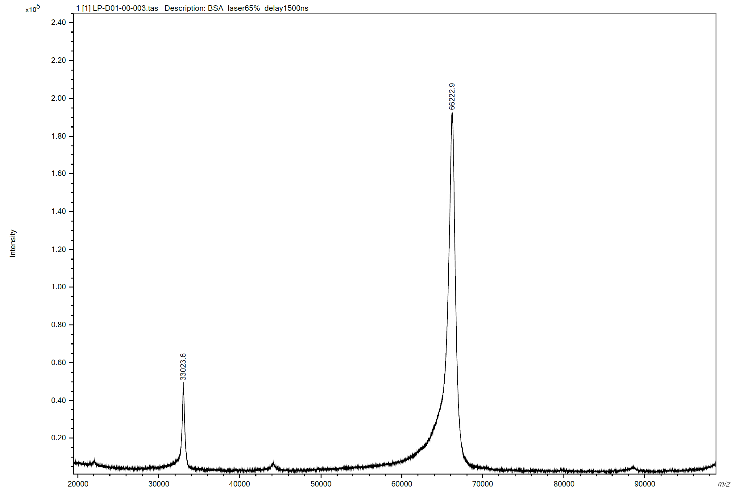
ผลวิเคราะห์ (1)
ตัวอย่างการวิเคราะห์ (2)
Sample and matrix information | |
Sample | Polyethylene glycol (PEG) |
Sample concentration | 10 mg/mL in DDI water |
Matrix | α-cyano-4-hydroxycinnamic acid (CHCA) |
Matrix concentration | 10 mg/mL in 50% Acetonitrile/water and 0.1% Trifluoroacetic acid (TFA) |
Cationization agent | 10 mg/mL NaI in water |
Sample deposit method | Dried-droplet |
Sample : Matrix ratio | 1:1 |
MALDI-TOF MS parameter | |
Mode | Spiral mode |
Ion polarity mode | Positive |
Mass range m/z | 1,000-4,000 |
Laser intensity | 45% |
Laser frequency | 20 Hz |
Delay time | 400 ns |
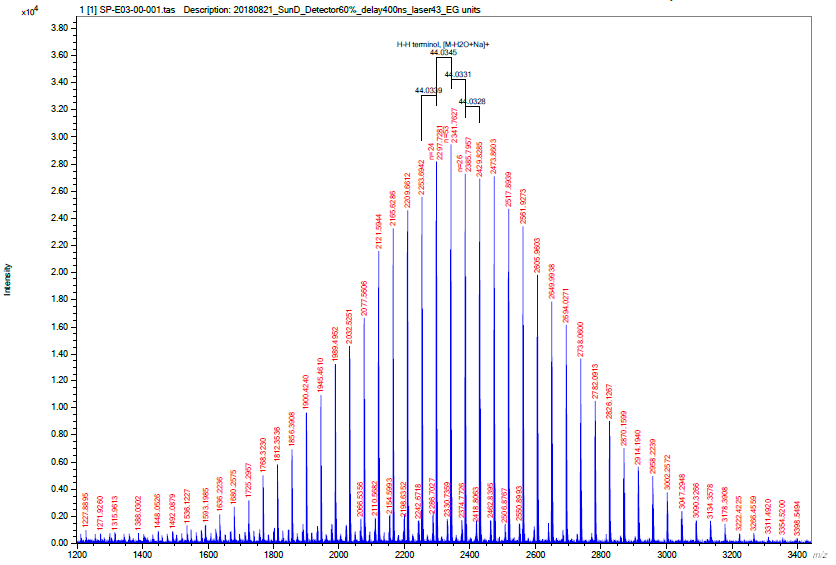
ผลวิเคราะห์ (2)
เอกสารอ้างอิง
แม้น อมรสิทธิ์ และคณะ, 2555 “หลักการและเทคนิคการวิเคราะห์เชิงเครื่องมือ Principle and Techniques of Instrumental Analysis Part II Chromatography and Others”. กรุงเทพฯ: ชวนพิมพ์ 50. 623 น.
Castoro, J. A., Köster, C., and Wilkins, C. L., 1992. Matrix-assisted laser desorption/ionization of high-mass molecules by Fourier-transform mass spectrometry. Rapid Comm. Mass Spectrom. 6, 239-241
Griffiths, J., 2008. A brief history of mass spectrometry. Anal. Chem. 80, 5678-5683.
Hillenkamp, F. and P.- Katalinic, J., 2007. “MALDI MS: A Practical guide to instrumentation, methods and applications”, WILEY-VHC: Weinheim, Germany, 362pp.
Kona, B., Weidner, St. M. and Friedrich J. F., 2005. Epoxidation of polydienes investigated by MALDI-TOF mass spectrometry and GPC-MALDI Coupling. Int. J. Polym. Anal. 10, 85–108.
Leopold, J., Popkova, Y., Engel. K.M., and Schiller, J. 2018. Recent developments of useful MALDI matrices for the mass spectrometric characterization of lipids. Biomolecules. 8(4), 173.
Li, L., 2009. “MALDI Mass Spectrometry for Synthetic Polymer Analysis”, WILEY: New York, 299 pp.
Nielen, M. W.F., 1999. MALDI time-of-flight mass spectrometry of synthetic polymers. Mass Spectrom. Rev. 18, 309- 344.
https://www.360marketupdates.com/global-maldi-tof-mass-spectrometry-market-14857951
ปวีณา เอกพรรณ
เจ้าหน้าที่บริการวิทยาศาสตร์
ศูนย์เครื่องมือวิจัยวิทยาศาสตร์และเทคโนโลยี จุฬาลงกรณ์มหาวิทยาลัย